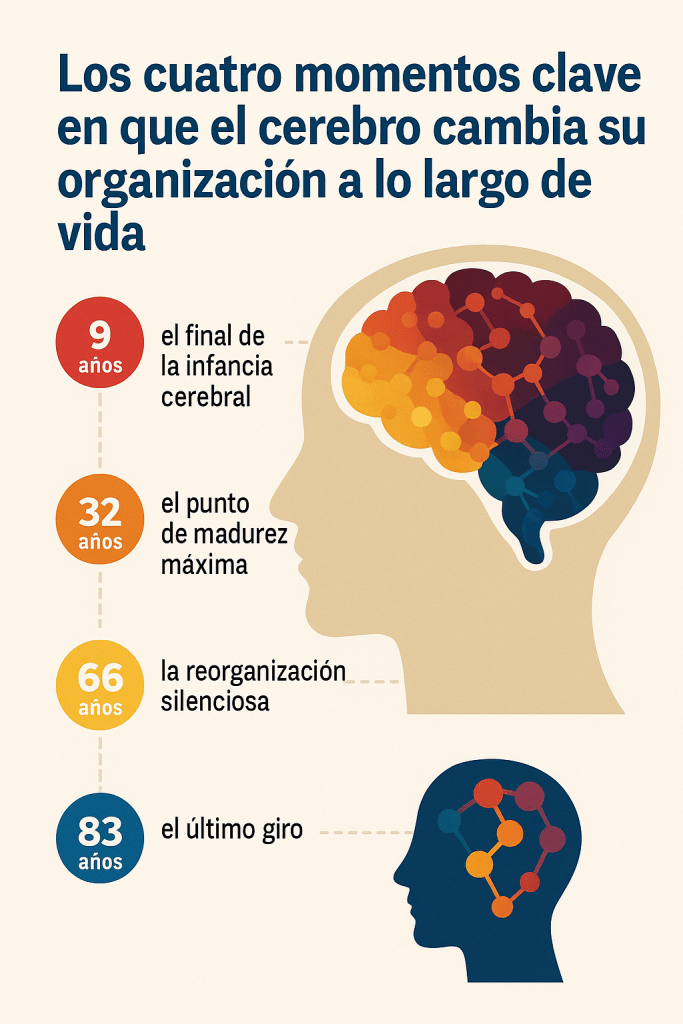
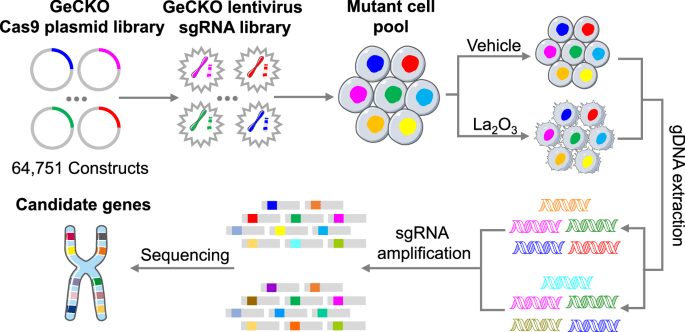
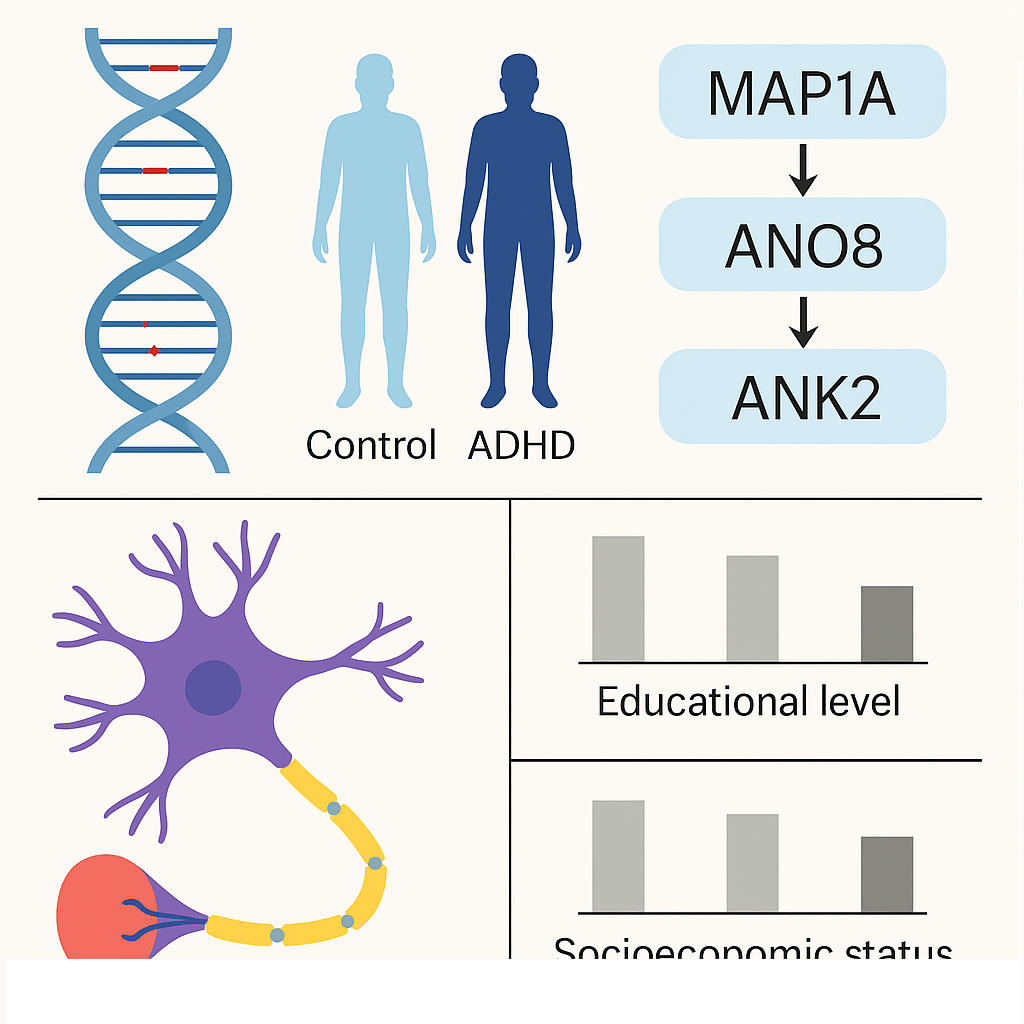
Por Héctor Romo-Parra
Los bebés humanos aprenden a hablar escuchando e imitando a sus padres. Primero balbucean sonidos sin sentido, y poco a poco, con la ayuda de mamá y papá que responden y les enseñan, logran formar palabras claras. Hasta hace poco, los científicos pensaban que los humanos éramos los únicos primates capaces de aprender a comunicarnos de esta manera.
Pero un fascinante descubrimiento ha revelado que no somos tan únicos como creíamos.