Por Carmen Rubio
La microglía dejó de ser “la célula olvidada” del sistema nervioso. Hoy sabemos que estas células inmunes residentes del cerebro son protagonistas silenciosas: ayudan a que las conexiones funcionen bien, defienden frente a infecciones y limpian lo que ya no sirve. Pero cuando se desregulan, también pueden alimentar una inflamación crónica que daña neuronas y favorece enfermedades neurodegenerativas.
En nuestro nuevo artículo de revisión, publicado en Neuroglia 2026, contamos esta doble historia: cómo la microglía protege el cerebro… y cómo, bajo ciertas condiciones, puede volverse parte del problema.
Quédate para saber más de nuestra nueva propuesta
¿Qué es exactamente la microglía?
Imagina una red de “vigilantes” repartidos por todo el cerebro. Eso es, a grandes rasgos, la microglía. Son células de origen inmunológico que llegaron muy temprano durante el desarrollo y se quedaron a vivir ahí para siempre, autorrenovándose.
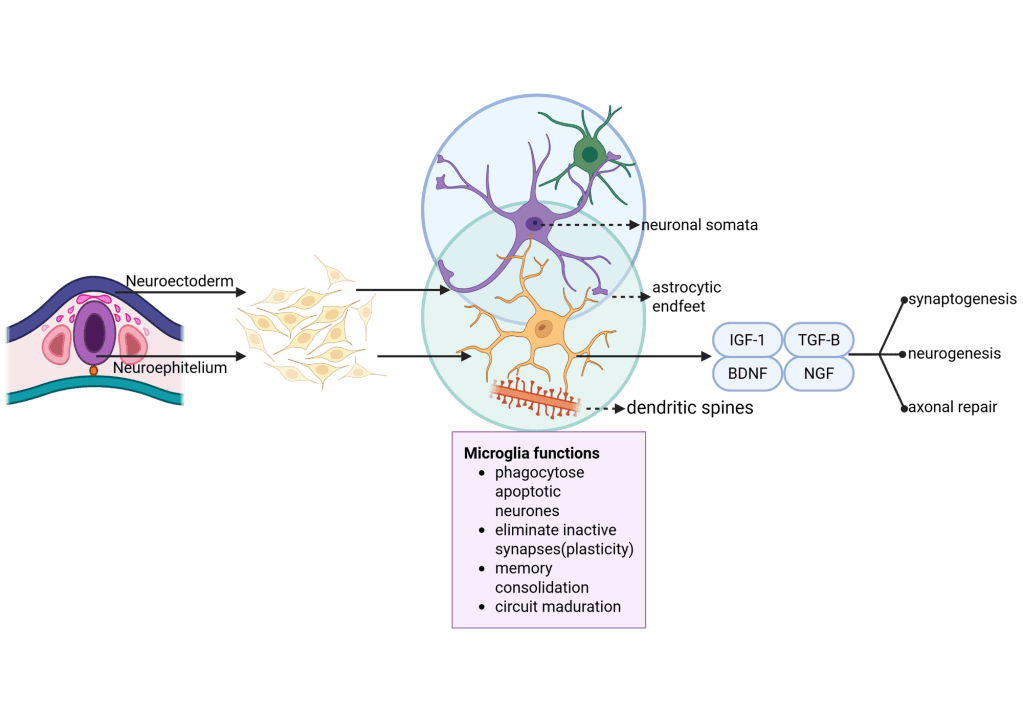


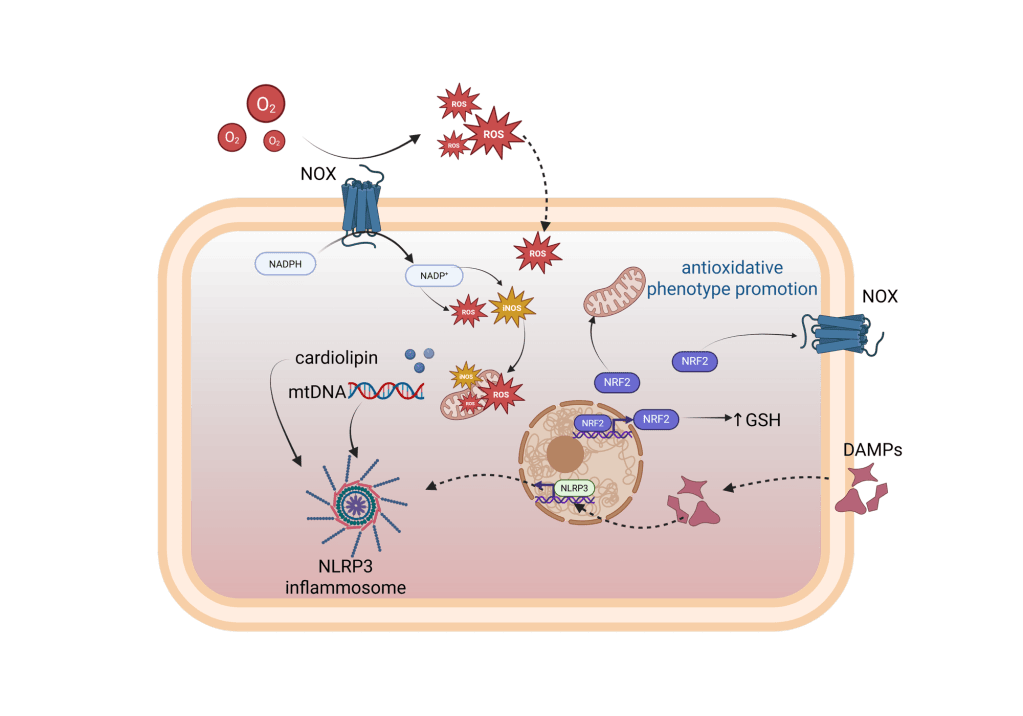
En un cerebro sano, la microglía suele tener un aspecto muy ramificado, con muchas prolongaciones finas que se mueven constantemente. Con eso:
- Detectan cambios pequeños en el entorno (señales químicas, energía, actividad eléctrica).
- Eliminan restos celulares y neuronas que ya han completado su ciclo.
- Podan sinapsis débiles o redundantes para afinar los circuitos, algo clave en el desarrollo y en el aprendizaje.
- Liberan factores que cuidan a las neuronas y ayudan a que las conexiones se fortalezcan.
Lejos de ser solo “células inflamatorias”, la microglía actúa como jardinero, personal de limpieza y servicio de mantenimiento del cerebro.
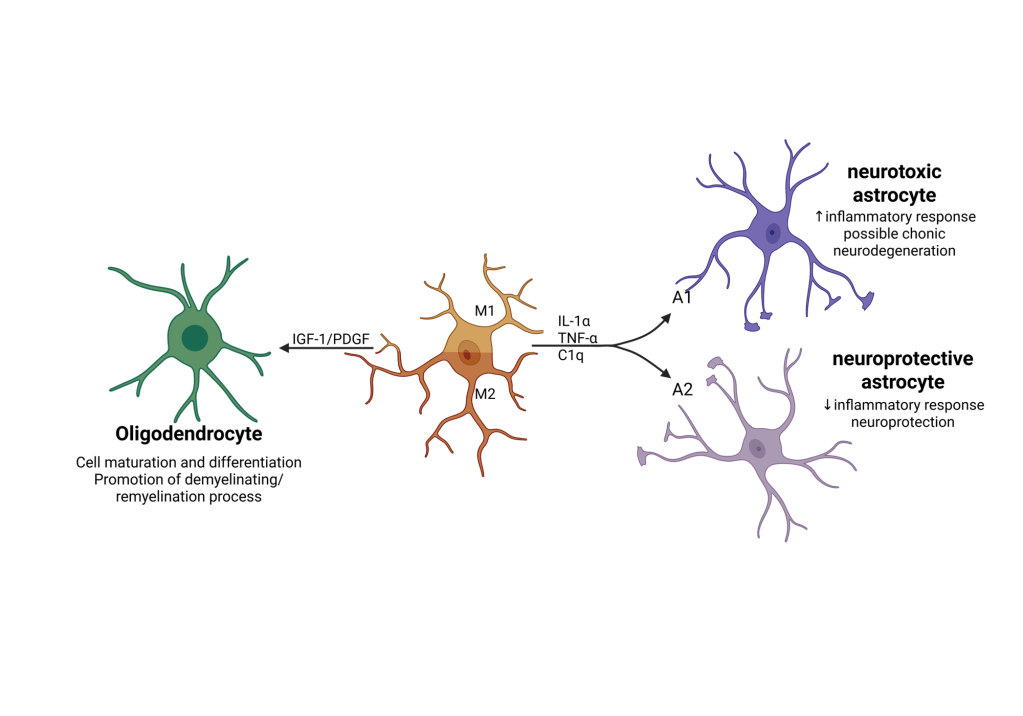
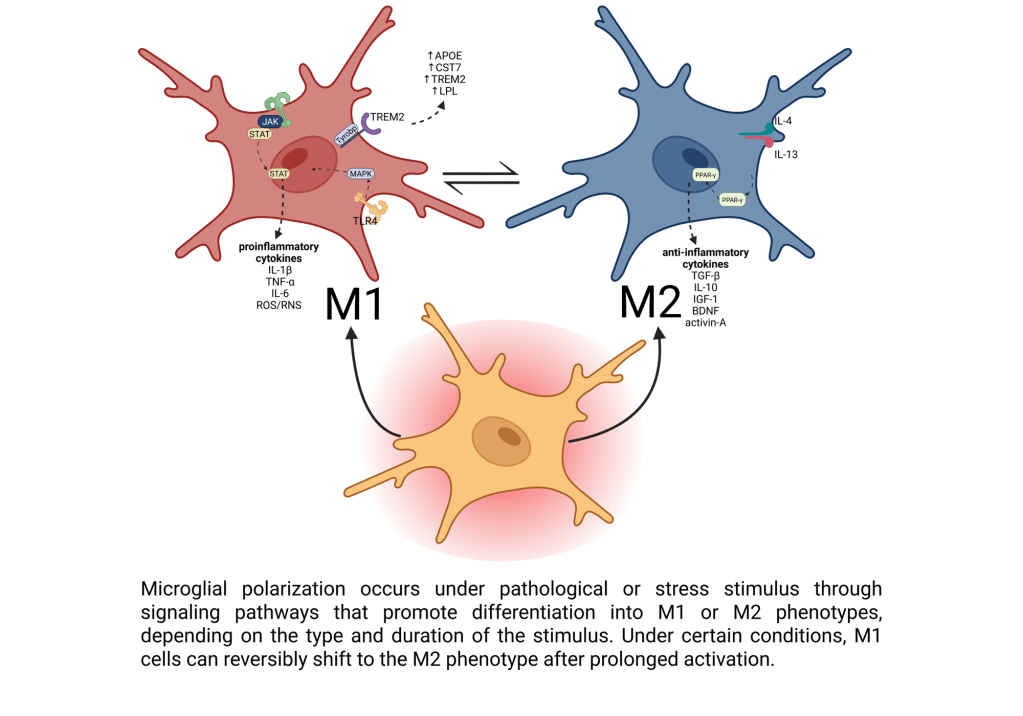
Más allá de M1 y M2: la microglía no es blanco o negro
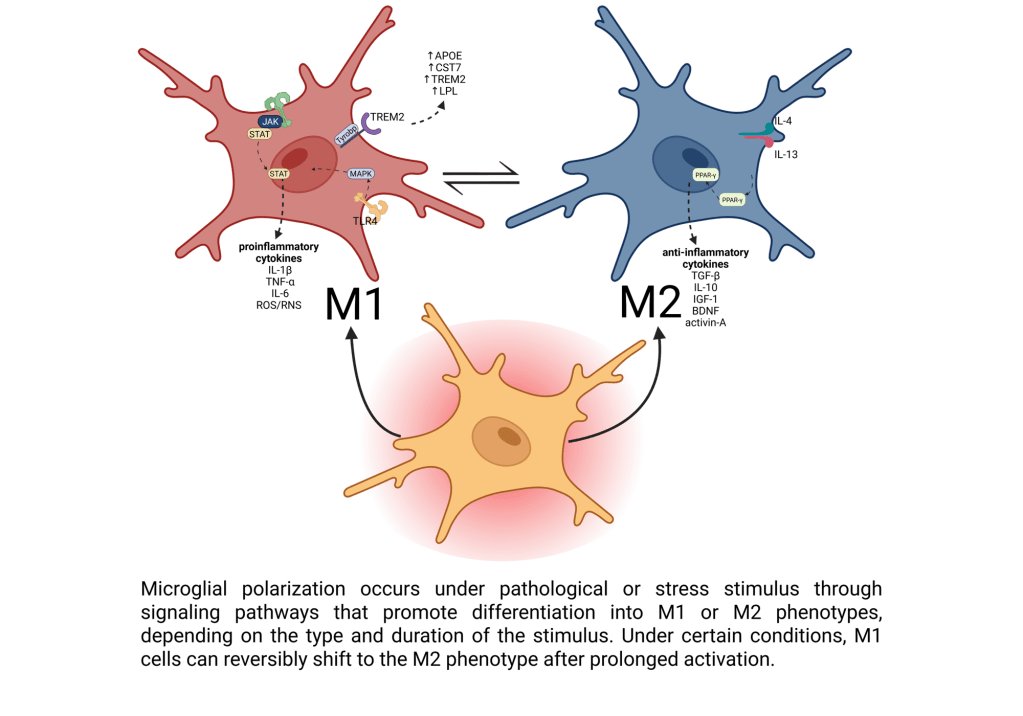
Durante años se usó una clasificación muy simple:
- M1: microglía proinflamatoria, asociada a daño.
- M2: microglía “reparadora”, asociada a protección.
En la revisión explicamos por qué ese esquema se ha quedado corto. Gracias a técnicas modernas que analizan célula por célula, hoy sabemos que la microglía adopta muchos estados intermedios, según:
- La región del cerebro donde se encuentra.
- La etapa de la vida (desarrollo, adultez, vejez).
- El tipo de agresión (proteínas mal plegadas, infecciones, traumatismos, etc.).
Entre esos estados están, por ejemplo, las microglías asociadas a enfermedad, que aparecen alrededor de placas de Alzheimer o en lesiones de Parkinson y ELA. No son simple “M1”, sino programas complejos que intentan a la vez contener el daño y adaptarse a un entorno tóxico.
Energía y oxidación: cómo el metabolismo cambia la personalidad de la microglía
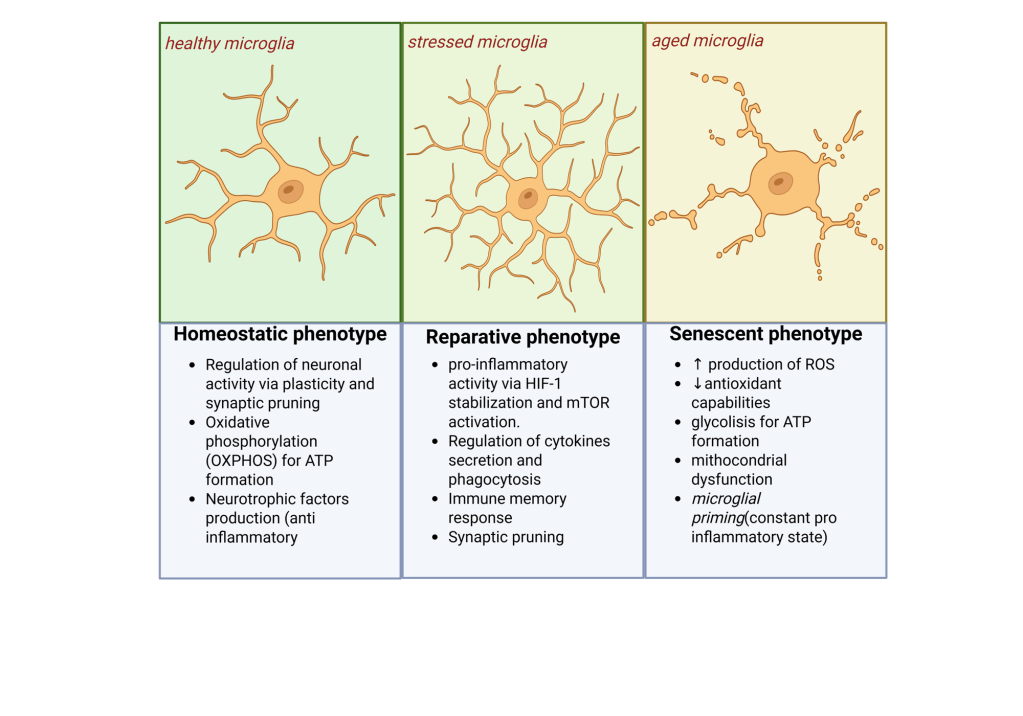
Uno de los mensajes centrales del artículo es que la forma en que la microglía obtiene energía condiciona su comportamiento:
- Cuando se inclina hacia una respuesta inflamatoria, usa sobre todo glucólisis (quema rápida de glucosa), similar a un “modo emergencia”.
- Cuando está en un perfil más reparador, depende más de la respiración mitocondrial y de la oxidación de grasas, un modo más eficiente y sostenible.
Cuando las mitocondrias de la microglía fallan y se acumulan especies reactivas de oxígeno (moléculas muy oxidantes), se activa un círculo vicioso: se liberan señales de daño que encienden aún más la inflamación y activan complejos como el inflamasoma NLRP3, muy implicado en enfermedades neurodegenerativas.
Envejecimiento: cuando la microglía se cansa
Con la edad, estas células dejan señales claras de desgaste:
- Acumulan pigmentos y residuos que no logran digerir del todo.
- Pierden eficiencia para limpiar restos y sinapsis que sobran.
- Mantienen un nivel de inflamación bajo pero constante.
A esto se le llama primado microglial: la célula queda en un estado de “alerta crónica” y responde de forma exagerada ante nuevas agresiones. En el artículo discutimos cómo ese cambio contribuye a que el cerebro envejecido sea más vulnerable a Alzheimer, Parkinson, ELA y otros trastornos.
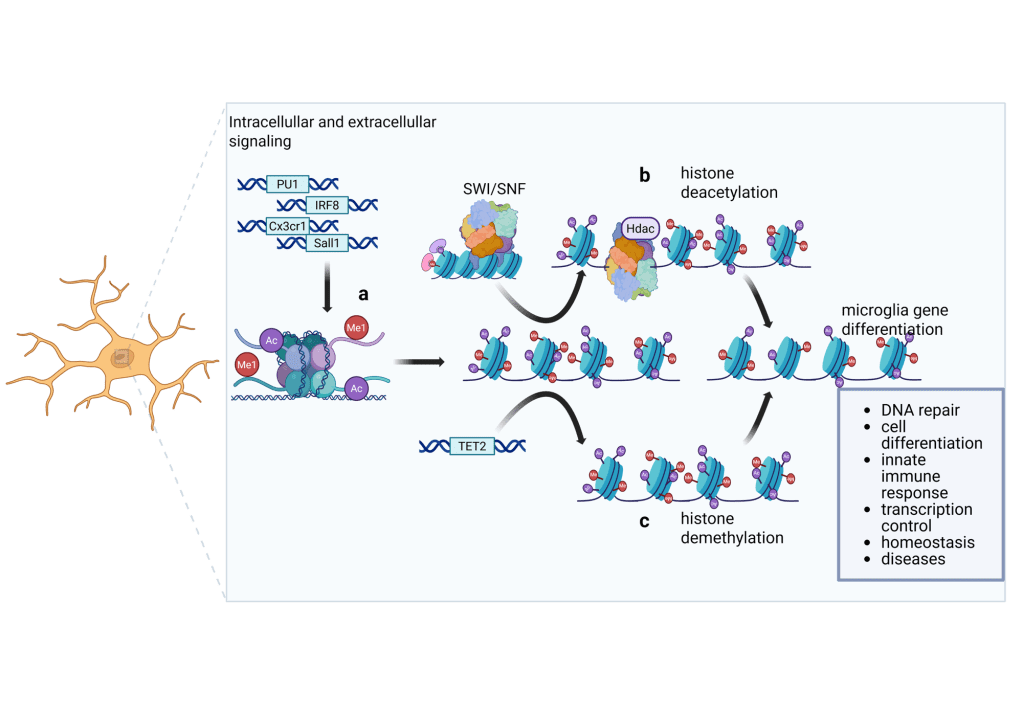
Epigenética y memoria: la microglía recuerda lo que ha vivido
La microglía no solo responde a lo que pasa hoy. También recuerda exposiciones anteriores a infecciones, inflamación o estrés, a través de cambios químicos sobre su ADN y sus proteínas de empaquetamiento (las histonas).
Ese recuerdo epigenético puede ser útil (respuesta más rápida y eficiente) o convertirse en un problema si fija un programa inflamatorio que ya no se apaga. En la revisión analizamos cómo esta “memoria innata” puede marcar la diferencia entre una respuesta protectora y una inflamación crónica dañina.
Una red de diálogo: microglía, astrocitos y neuronas
En Neuro psico locos nos gusta insistir en que el cerebro no son solo neuronas. Es una red de células hablando entre sí. La microglía mantiene conversaciones continuas con:
- Neuronas: que le envían señales de “todo bien” o “algo va mal”.
- Astrocitos: que pueden volverse más tóxicos o más protectores dependiendo de las sustancias que les manda la microglía.
- Oligodendrocitos: que dependen de un entorno glial sano para producir y mantener la mielina, la “capa aislante” de los axones.
Según cómo se dé ese diálogo, el cerebro puede resolver una inflamación y volver al equilibrio… o quedarse atrapado en un estado proinflamatorio que poco a poco va dañando redes y funciones cognitivas.
¿Podemos ayudar a la microglía desde la dieta y los compuestos naturales?
Otra parte del trabajo revisa estudios donde distintos compuestos naturales (como la curcumina, el resveratrol, la quercetina o los ácidos grasos omega‑3) parecen:
- Bajar la producción de moléculas inflamatorias.
- Mejorar la salud mitocondrial.
- Reforzar los sistemas antioxidantes.
No son “cura milagrosa”, pero sí pistas de que, combinados con otros abordajes, podrían ayudar a mantener a la microglía en estados más protectores y menos dañinos.
¿Por qué importa todo esto?
Porque entender esta doble cara de la microglía nos permite:
- Reconocer que no es buena ni mala por definición, sino altamente plástica.
- Identificar momentos clave en los que podríamos intervenir terapéuticamente.
- Diseñar estrategias que apaguen la inflamación crónica sin bloquear las funciones de vigilancia, poda sináptica y reparación.
En resumen, en la revisión proponemos que la disfunción microglial —alimentada por estrés oxidativo, fallos mitocondriales y cambios epigenéticos persistentes— es uno de los ejes centrales que conectan neuroinflamación, pérdida de sinapsis y vulnerabilidad neuronal.
Si queremos proteger el cerebro a largo plazo, no basta con pensar en neuronas: hay que aprender a cuidar también de estas vigilantes discretas que, según el contexto, pueden salvar o dañar nuestras redes neuronales.
Esta entrada está basada en nuestro artículo de revisión en Neuroglia 2026 sobre el papel dual de la microglía en la salud y la enfermedad del cerebro, adaptado aquí para un público general al estilo de Neuropsicolocos.

Deja un comentario